卫材展示阿尔茨海默病和痴呆方面的管线产品的最新数据
东京2020年11月18日 /美通社/ -- 卫材株式会社(总部:东京,CEO:Haruo Naito,“卫材”)在2020年11月4日至7日通过网络会议形式举行的第13届阿尔茨海默病临床试验(CTAD)会议上进行了7次报告,包括研究性药物抗β淀粉样蛋白(Aβ)原纤维抗体lecanemab(开发代码:BAN2401)的最新数据。
卫材将进行4次关于lecanemab的口头报告。第一次报告将介绍在临床前阿尔茨海默病(AD)患者中新启动的III期临床研究AHEAD 3-45的临床研究设计和初始筛选结果。第二次报告将介绍在早期AD患者中进行的II期临床研究(研究201)获得的淀粉样蛋白相关影像学异常-水肿(ARIA-E)表现的最新分析结果。第三次报告将介绍研究201正在进行的开放性扩展(OLE)研究前12个月治疗期间观察到的脑部Aβ总量变化和ARIA-E表现的初步分析结果。第四次报告将介绍在早期AD患者中进行的III期临床研究Clarity AD当前入组的受试者的基线特征。
其他主题包括与临床试验相关的在小鼠模型中观察到的lemborexant对AD中不规则睡眠-觉醒节律障碍(Irregular Sleep-Wake Rhythm Disorder,ISWRD)的有效性,以及新型抗微管结合域(MTBR)tau抗体E2814的I期、首次用于人体(FIH)、单次递增剂量(SAD)研究的结果。
关于aducanumab,Biogen Inc.(总部:美国马萨诸塞州坎布里奇)将就其IIIb期重新给药研究EMBARK的设计进行口头介绍。2020年8月,向美国食品药品监督管理局(FDA)提交的使用aducanumab治疗AD的生物制品许可申请(BLA)被接受,并获得了优先审评资格认定。
Lecanemab和aducanumab由卫材和Biogen Inc.共同开发。
与Sysmex Corporation(总部:Hyogo,“Sysmex”)联合研究的、简化血液AD诊断方法的工作进展,将进行海报展示,介绍“通过全自动免疫分析(HISCLTM*)测量血浆Aβ比值,预测根据淀粉样蛋白PET Centiloid标准化结果定义的淀粉样蛋白阳性”。
卫材在AD和痴呆的药物研发方面拥有35年的经验积累,希望能够通过多维度的整体方法实现痴呆的防治。卫材致力于加快新药研发,以推动解决患者及其家属未满足的医疗需求,增加其获益。
卫材口头演示介绍的主题列表
处于研究阶段的药物,会议序号 | 主题/计划日期和时间(东部标准时间) |
BAN2401 | BAN2401治疗临床前阿尔茨海默病的AHEAD 3-45研究:研究 |
BAN2401 | “Clarity AD:一项评价BAN2401治疗早期阿尔茨海默病的III |
BAN2401 | BAN2401和早期阿尔茨海默病的ARIA-E:早期阿尔茨海默病II |
BAN2401 | 在早期阿尔茨海默病受试者中进行的IIb期研究 |
Lemborexant | 阿尔茨海默病中的不规则睡眠-觉醒节律障碍:使用SAMP8小鼠 |
E2814 | 一项在健康志愿者中开展的新型抗Tau治疗性抗体E2814的I期、 |
卫材海报展示的主题列表
处于研究阶段的药物,报告序号 | 主题/计划日期和时间(东部标准时间) |
一般性介绍 | 阿尔茨海默病患者及其看护者的临床评估量表结果与社交媒体 |
Biogen口头演示介绍的主题列表
处于研究阶段的药物,会议序号 | 主题/计划日期和时间(东部标准时间) |
Aducanumab | EMBARK:一项在符合条件的阿尔茨海默病受试者中评价 |
Biogen海报展示的主题列表
处于研究阶段的药物,报告序号 | 主题/计划日期和时间(东部标准时间) |
一般性介绍 | 使用美国国家阿尔茨海默病协调中心(National Alzheimer’s |
Sysmex-卫材海报展示的主题列表
处于研究阶段的药物,报告序号 | 主题/计划日期和时间(东部标准时间) |
一般性介绍 | 通过全自动免疫分析测量的血浆Aβ比值,预测根据淀粉样蛋 |
*HISCLTM是Sysmex Corporation的商标。 |
[编者注]
1. 关于卫材和Biogen联合开发AD治疗药物
卫材和Biogen在AD治疗药物的开发和商业化方面进行了广泛的合作。卫材是联合开发lecanemab(开发代码:BAN2401)(一种抗Aβ原纤维抗体)的领导者,Biogen是联合开发aducanumab(Biogen用于治疗AD患者的试验性抗Aβ抗体)的领导者,卫材和Biogen计划在全球范围内申请这两种药物的上市许可。如果获得批准,卫材和Biogen还将在美国、欧盟和日本等主要市场共同推广这两种药物。
2. 关于卫材与Sysmex的合作
卫材和Sysmex于2016年2月签订了一项全面的非排他性合作协议,旨在寻找新的痴呆诊断方法。两家公司利用彼此的技术和知识,共同寻找下一代诊断方法,以便实现早期诊断、选择治疗方案和定期监测痴呆的治疗效果。
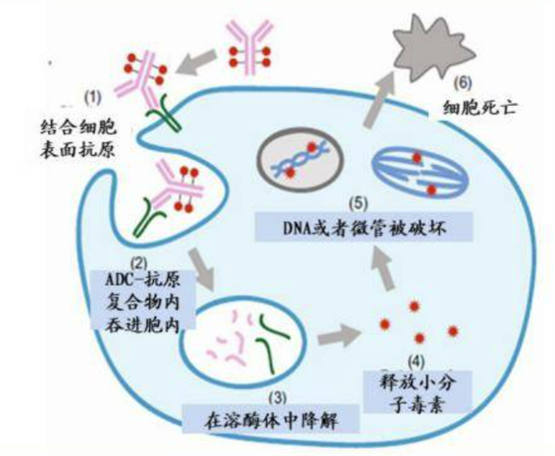
3. 关于Lecanemab(开发代码:BAN2401)
Lecanemab是一种治疗AD的人源化单克隆抗体,是卫材和BioArctic AB(总部:瑞典)之间战略研究合作的成果。Lecanemab可选择性结合中和并消除可溶性、毒性Aβ聚集体(原纤维),这些聚集体被认为加速了AD的神经系统变性进程。因此,lecanemab可能对疾病病理机制产生影响,并减缓疾病进展。根据2007年12月与BioArctic签订的协议,卫材获得了用于治疗AD的lecanemab的全球研究、开发、生产和上市的权利。目前,lecanemab治疗早期AD的全球III期临床研究(Clarity AD)正在进行中。Lecanemab正在由卫材和Biogen Inc.联合开发。美国国家卫生研究院、国家老龄化研究所为A45研究(拨款编号R01AG061848)和A3研究(拨款编号R01AG054029)提供资金。
4. 关于Lemborexant
Lemborexant是卫材自主研发的一种小分子食欲素受体拮抗剂,通过竞争性结合食欲素受体的两种亚型(食欲素受体1和2)抑制食欲素神经传递。Lemborexant对食欲素受体2的快速开/关受体动力学也可抑制非REM睡眠,可能影响lemborexant改善入睡和维持睡眠的潜力。2020年6月,lemborexant以产品名称DAYVIGOTM在美国上市,用于治疗以入睡困难和/或维持睡眠困难为特征的成人失眠患者;2020年7月,lemborexant以产品名称DAYVIGO®在日本上市,用于治疗失眠。卫材已在加拿大、澳大利亚和香港提交了DAYVIGO的新药申请。此外,一项在轻中度阿尔茨海默病痴呆导致的ISWRD患者中进行的lemborexant II期临床研究正在进行中。
5. 关于Aducanumab(开发代码:BIIB037)
Aducanumab是一种用于治疗AD的试验性人单克隆抗体。基于临床数据,aducanumab可能影响基础疾病的病理生理机制,减缓认知和功能下降,并改善患者的日常生活活动能力,包括个人理财、做家务(如清洁、购物和洗衣)以及独立出门旅行。如果获得批准,aducanumab将成为第一个能够有意义地改变阿尔茨海默病患者病程的治疗方法。
Biogen根据合作开发和许可协议从Neurimmune获得了aducanumab的许可。自2017年10月以来,Biogen和卫材在全球范围内合作开发和商业化aducanumab。
EMERGE和ENGAGE是III期、多中心、随机、双盲、安慰剂对照、平行组研究,旨在评价aducanumab的有效性和安全性。这两项研究的主要目的是通过临床痴呆评定量表-总分(CDR-SB)评分的变化,评价每月一次给予aducanumab与安慰剂相比在减少认知和功能损害方面的有效性。次要目的是使用简易精神状态检查表(MMSE)、阿尔茨海默病评估量表-认知子量表13项(ADAS-Cog 13)和阿尔茨海默病合作研究-日常生活活动量表-轻度认知障碍版本(ADC-ADL-MCI),评估每月一次给予aducanumab与安慰剂相比对临床评分降低的影响。